期刊VIP學(xué)術(shù)指導(dǎo) 符合學(xué)術(shù)規(guī)范和道德
保障品質(zhì) 保證專業(yè),沒有后顧之憂
期刊VIP學(xué)術(shù)指導(dǎo) 符合學(xué)術(shù)規(guī)范和道德
保障品質(zhì) 保證專業(yè),沒有后顧之憂
來源:期刊VIP網(wǎng)所屬分類:業(yè)內(nèi)新聞時(shí)間:瀏覽:次
肺癌是世界上最常見的惡性腫瘤之一。基因突變是非小細(xì)胞肺癌發(fā)生發(fā)展和轉(zhuǎn)移的重要因素。KRAS突變是非小細(xì)胞肺癌中最主要的基因突變之一,近年來針對(duì)KRAS G12C抑制劑的開發(fā)取得了突破性進(jìn)展,但是針對(duì)KRAS其它突變?nèi)鏚RAS G12D等仍缺乏有效的靶點(diǎn)藥物。
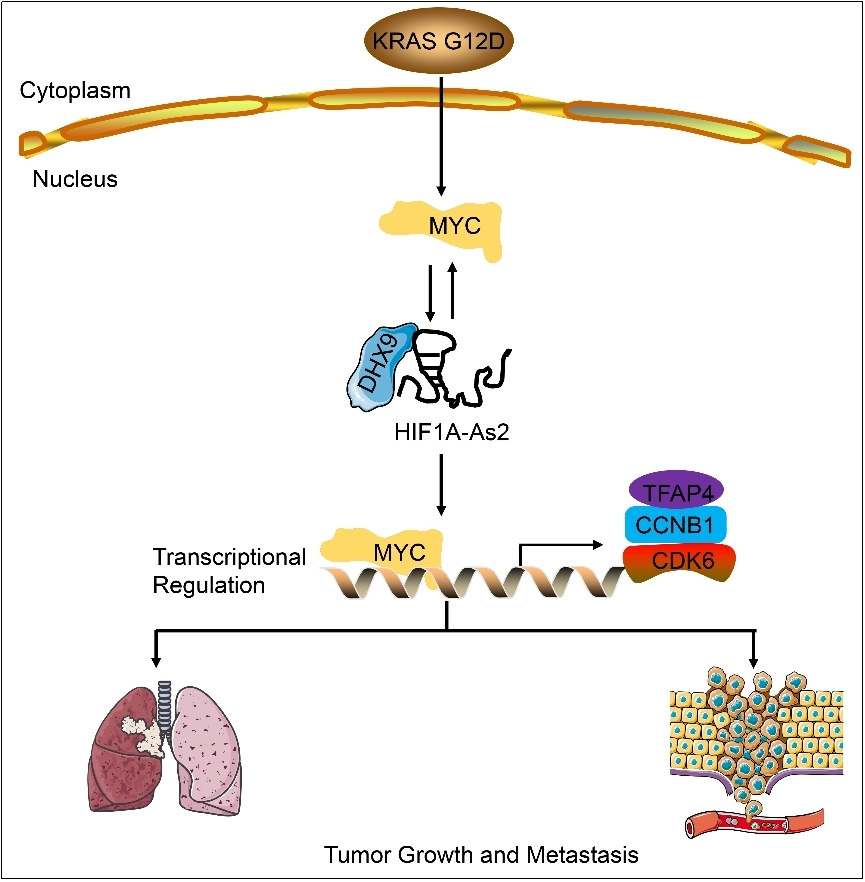
近日,蘭州大學(xué)公共衛(wèi)生學(xué)院教授石磊團(tuán)隊(duì)在《細(xì)胞死亡與分化》發(fā)表研究成果,揭示了lncRNA HIF1A-As2與MYC形成雙向調(diào)控環(huán)路,促進(jìn)KRAS G12D誘導(dǎo)的非小細(xì)胞肺癌發(fā)生發(fā)展和轉(zhuǎn)移,為研究lncRNA在腫瘤中的作用機(jī)制提供新的思路,為非小細(xì)胞肺癌的診斷和治療提供新的靶點(diǎn),具有重要的理論意義和醫(yī)學(xué)價(jià)值。
通過RNA-seq,團(tuán)隊(duì)發(fā)現(xiàn)KRAS調(diào)控的80條lncRNA中,HIF1A-As2上調(diào)幅度最大。通過TCGA(The Cancer Genome Atlas)數(shù)據(jù)分析,發(fā)現(xiàn)HIF1A-As2在肺癌組織表達(dá)明顯高于正常組織,并且與細(xì)胞增殖和腫瘤發(fā)生息息相關(guān)。近來,有文獻(xiàn)報(bào)道HIF1A-As2可以促進(jìn)在非小細(xì)胞肺癌耐藥性和腫瘤發(fā)生發(fā)展。但是在已發(fā)表論文中,HIF1A-As2主要作為microRNA海綿分子參與腫瘤發(fā)生發(fā)展,在其它層面的分子機(jī)制仍不清楚,尤其在非小細(xì)胞肺癌中的生物學(xué)功能和分子調(diào)控機(jī)理也有待闡釋。
通過RAP-MS(RNA Antisense Purification Mass Spectrometry)和CLIP(Cross-linking RNA Immunoprecipitation)實(shí)驗(yàn),課題組初步篩選出HIF1A-As2結(jié)合蛋白質(zhì)DHX9。DHX9,又名RHA(RNA Helicase A),主要參與DNA復(fù)制、轉(zhuǎn)錄調(diào)控、RNA運(yùn)輸和microRNA生物合成等多項(xiàng)生物學(xué)功能。通過RNA-seq、RT-qPCR等方法,課題組發(fā)現(xiàn)HIF1A-As2不調(diào)控鄰近基因(順式調(diào)控),主要調(diào)控遠(yuǎn)端基因,揭示了其反式調(diào)控基因表達(dá)的功能。通過GSEA(Gene Set Enrichment Analysis)和GO(Gene Ontology)功能分析,課題組發(fā)現(xiàn)HIF1A-As2參與轉(zhuǎn)錄調(diào)控,與MYC通路密切相關(guān)。課題組進(jìn)一步發(fā)現(xiàn),HIF1A-As2通過招募DHX9到MYC啟動(dòng)子,從而激活MYC轉(zhuǎn)錄調(diào)控,影響下游基因表達(dá),促進(jìn)細(xì)胞增殖和轉(zhuǎn)移。此外,MYC可以結(jié)合在HIF1A-As2區(qū)域,從而轉(zhuǎn)錄后激活HIF1A-As2的表達(dá)水平。綜上,HIF1A-As2和MYC形成雙向反饋環(huán)路,促進(jìn)腫瘤發(fā)生發(fā)展。
最后通過PDX動(dòng)物模型,課題組發(fā)現(xiàn)HIF1A-As2 antisense oligonucleotide(ASO)聯(lián)合MYC小分子抑制劑,可以有效抑制腫瘤增長;通過KRASLSLG12D誘導(dǎo)小鼠模型,HIF1A-As2 ASO可以增強(qiáng)機(jī)體對(duì)Cisplatin的敏感性,抑制腫瘤轉(zhuǎn)移。